濃厚血小板血漿(Platelet-Rich Plasma,PRP)在再生醫學領域中的應用,近年來已獲得廣泛關注。這是一種由自體血液經離心處理後取得的血漿,其中富含高濃度的血小板與多種生長因子,可刺激組織修復、抗發炎與血管新生等生物學反應。
自1987年PRP首次在心臟手術中應用以來,其臨床適應症已迅速擴展至骨科、復健醫學、皮膚科、泌尿科等多個領域。儘管其潛力被高度評價,PRP仍面臨標準化不足與療效爭議等挑戰,值得進一步探討其生物機轉、應用現況與未來發展。
成分與生物活性機制
PRP之所以具備修復功能,與其所含有的大量生長因子息息相關。血小板中的α顆粒在被活化後會釋放出多種細胞激素與訊息分子,其中包括血小板衍生生長因子(PDGF)、轉化生長因子-β(TGF-β)、血管內皮生長因子(VEGF)、胰島素樣生長因子-1(IGF-1)、表皮生長因子(EGF)與鹼性纖維母細胞生長因子(bFGF)等。
這些因子可分別調控細胞增生、分化、趨化與血管生成。例如,TGF-β不僅能調節免疫細胞的活化與發炎反應,更能透過Smad訊號傳遞路徑促進細胞外基質的產生,有助於纖維組織修復。PDGF則可活化周圍的幹細胞並誘導其向損傷部位遷移與增殖,而VEGF則是血管新生的關鍵調節者,可為受損組織提供必要的氧氣與營養來源。
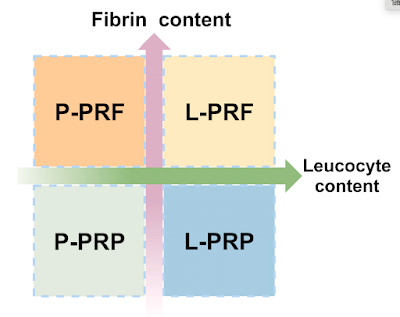
PRP分類與應用型態
PRP的分類亦反映其生物學特性。依據白血球與纖維蛋白含量的多寡,學者將PRP區分為純血小板血漿(P-PRP)、富含白血球之PRP(L-PRP)、純血小板纖維蛋白(P-PRF)與含白血球之PRF(L-PRF)。
P-PRP與L-PRP通常以液態或活化後注射形式應用於軟組織或關節修復;而P-PRF與L-PRF則因富含纖維蛋白結構,可形成凝膠態,作為手術敷料或組織工程支架。這些類型之間在抗發炎能力、釋放生長因子時間與修復效果方面均有所差異,需依據臨床需求進行選擇。
運動醫學\骨科應用實證
在運動醫學與骨科領域中,PRP已被廣泛應用於治療退化性關節炎、肌腱與韌帶損傷、骨折癒合不全與周邊神經損傷等情況。以退化性膝關節炎為例,該病症通常涉及軟骨磨損與滑膜炎反應,導致疼痛與行動受限。研究顯示,PRP可透過抑制發炎因子如IL-1與TNF-α的表現,降低軟骨降解酵素活性,並刺激軟骨細胞與滑膜細胞分泌保護性基質蛋白,進而延緩病程進展。動物實驗與臨床試驗均指出,對於輕中度關節炎患者,PRP注射可顯著改善疼痛與關節功能,甚至可成為玻尿酸與類固醇注射之外的替代性保守治療方式。
此外,在肌腱與韌帶修復方面,PRP的作用尤為重要。肌腱與韌帶屬於血流供應稀少的組織,修復速度緩慢。PRP中所含之bFGF與TGF-β可刺激成纖維細胞與肌腱細胞增殖,促進膠原蛋白生成,並加速傷口癒合。在臨床應用中,PRP常被注射至阿基里斯腱、膝關節十字韌帶與肩旋轉肌群等常見損傷部位,研究亦顯示結合復健治療後的恢復效果更為顯著。
PRP對於周邊神經再生亦有潛力。例如於尺神經壓迫或撕裂傷的模型中,PRP可作為神經導管的內填材料,提供神經營養因子與支撐基質,誘導軸突正確延伸與髓鞘重建。一些臨床前研究亦指出,PRP具有減輕神經發炎、促進髓鞘形成與提升神經傳導速度的效益,有望應用於神經外科術後修復或慢性壓迫性神經病變的治療。
PRP的限制與風險
儘管濃厚血小板血漿的應用前景看好,當前仍存在多項限制。首先,各家醫療機構間的PRP製備方式缺乏一致性,包括離心速度、時間、抗凝劑使用與活化條件,導致最終產品在血小板濃度與活性成分上存在顯著差異,進而影響療效可比性。其次,臨床研究多為小規模、短期追蹤,缺乏大規模隨機對照試驗支持,難以評估其長期安全性與有效性。再者,部分個案報告指出PRP治療後可能出現感染、局部發炎、視覺異常等副作用,提醒臨床應謹慎評估患者適應症與風險因子。
未來研究展望
展望未來,要提升PRP在再生醫學的實用性與可信度,需從數個層面著手。其一,建立標準化的製備與品管流程,確保血小板與生長因子濃度達到療效所需門檻;其二,進行多中心、長期、大樣本的臨床試驗,驗證其在不同疾病情境中的實際效果與持久性;其三,深入探討PRP中各種生長因子的交互作用與訊號整合機轉,以利後續開發精準且個別化的治療策略。
小結
濃厚血小板血漿作為一項具有潛力的自體療法,其應用在運動醫學與骨科已顯示初步成果。唯有在嚴謹的科學研究與臨床實證支持下,PRP方能真正發揮其在再生醫療中的價值,為廣大病患帶來更加安全、有效的修復選擇。
參考文獻
iScience. 2025 Jan 3;28(2):111705.




沒有留言:
張貼留言